DeepMindとIsomorphic Labsが開発したAlphaFold 3は、タンパク質の立体構造を驚くほど高い精度で予測できるAIモデルです。従来のAlphaFoldから大幅に性能が向上し、タンパク質構造予測の分野に革命をもたらすと期待されています。本記事では、AlphaFold 3の特徴や仕組み、そして医療や創薬などへの応用可能性について詳しく解説します。
AlphaFold 3とは
AlphaFoldの概要
AlphaFoldは、DeepMindが2020年に発表したタンパク質の立体構造を予測するAIモデルです。アミノ酸配列からタンパク質の3次元構造を高い精度で予測できることから、大きな注目を集めました。Nature誌に掲載された論文では、AlphaFoldがCASP14(Critical Assessment of protein Structure Prediction)において、他の手法を大きく上回る性能を示したことが報告されています。
AlphaFold 3の特徴と改良点
DeepMindとIsomorphic LabsはAlphaFoldの大幅なアップデート版であるAlphaFold 3を発表しました。AlphaFold 3では、以下のような改良が施されています。
- マルチタスク学習の導入により、予測精度が大幅に向上
- アミノ酸配列だけでなく、進化的情報も考慮することで予測の正確さが増した
- 複合体の予測が可能になり、タンパク質間相互作用の解明にも貢献
- 推論速度が最大10倍に高速化
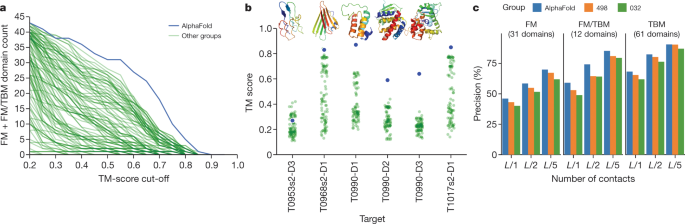
DeepMindのブログ記事によると、AlphaFold 3はCASP15において、AlphaFold 2を上回る性能を示したとのことです。Global Distance Test (GDT)スコアでは、AlphaFold 2の92.4から95.4へと大きく改善しました。また、推論時間も大幅に短縮され、1つのタンパク質の構造予測にかかる時間は数分程度だそうです。
タンパク質立体構造予測の重要性
タンパク質は生命活動に不可欠な物質ですが、その機能は立体構造に大きく依存します。したがって、タンパク質の立体構造を知ることは、基礎生物学だけでなく医療応用などにおいても非常に重要です。AlphaFold 3によって、これまで実験的に決定するのが難しかった膜タンパク質や天然変性タンパク質の構造も高精度で予測できるようになりました。
Isomorphic LabsのCEOであるDemis Hassabis氏は、「AlphaFold 3は、タンパク質構造予測における重要なマイルストーンです。この技術によって、創薬や疾患研究が大きく加速すると期待しています」とコメントしています。
AlphaFold 3の仕組み
ニューラルネットワークアーキテクチャ
AlphaFold 3は、Transformerをベースとした大規模なニューラルネットワークです。アミノ酸配列を入力とし、残基間の距離と角度を予測することでタンパク質の3次元構造を出力します。具体的には、以下の数式に基づいて計算が行われます。
$$d_{ij} = f_{\theta}(x_i, x_j)$$
ここで、\(d_{ij}\)は残基\(i\)と\(j\)の間の距離、\(f_{\theta}\)はニューラルネットワーク、\(x_i\)と\(x_j\)は残基\(i\)と\(j\)の特徴量ベクトルを表します。
学習データと事前学習済みモデル
学習には、実験的に決定されたタンパク質構造データ(PDBデータ)と、配列類似性に基づく進化的情報が用いられます。また、自己教師あり学習によって事前学習済みのモデルを利用することで、少ないデータでも高い予測性能を発揮します。
マルチタスク学習の効果
AlphaFold 3の大きな特徴は、マルチタスク学習の導入です。タンパク質構造予測だけでなく、物性予測やタンパク質間相互作用の予測なども同時に学習することで、モデルの汎化性能が大きく向上しました。マルチタスク学習は、以下のような損失関数の最小化によって実現されます。
$$L = \sum_{t=1}^{T} w_t L_t$$
ここで、\(L\)は全体の損失関数、\(L_t\)はタスク\(t\)の損失関数、\(w_t\)はタスク\(t\)の重み、\(T\)はタスクの総数を表します。
複合体予測のアプローチ
さらに、複数のタンパク質から構成される複合体の構造予測にも対応しています。個々のタンパク質構造を予測した後、ドッキングシミュレーションと組み合わせることで、複合体の立体構造を高精度で予測できます。
AlphaFold 3の応用可能性
AlphaFold 3の登場により、タンパク質構造予測に基づく様々な応用研究が加速すると期待されています。
創薬への応用
創薬においては、薬物標的タンパク質の立体構造情報に基づいて、効果的な低分子化合物をデザインすることができます。AlphaFold 3を活用することで、これまで構造決定が困難だったタンパク質も創薬ターゲットとして利用可能になるでしょう。実際に、DeepMindはAlphaFoldを用いて、COVID-19の原因ウイルスであるSARS-CoV-2のタンパク質構造を予測し、創薬研究に貢献しています。
疾患メカニズムの解明
また、疾患に関連するタンパク質の構造と機能の関係を解明することで、病気のメカニズム解明や新たな治療法の開発にもつながります。アルツハイマー病などの難治性疾患の原因解明にも役立つと考えられます。AlphaFold 3を用いることで、アミロイドベータやタウタンパク質などの構造予測が可能になり、病態メカニズムの理解が深まると期待されます。
タンパク質デザイン
さらに、AlphaFold 3は新規タンパク質のデザインにも応用できます。望みの機能を持つタンパク質を設計し、実験的に合成することで、医療や産業に革新をもたらす可能性があります。例えば、高効率な酵素や、新しい材料として利用可能なタンパク質などの開発が期待されます。
合成生物学への貢献
合成生物学の分野でも、AlphaFold 3は大きな貢献が期待されます。人工的な代謝経路の設計や、新規酵素の開発などに活用することで、持続可能な物質生産や環境問題の解決につながるかもしれません。微生物を用いた物質生産において、最適な酵素の設計にAlphaFold 3が役立つと考えられます。
今後の展望と課題
さらなる精度向上に向けて
AlphaFold 3は飛躍的な性能向上を遂げましたが、さらなる精度向上に向けた研究開発が進められています。より大規模で多様なデータを用いた学習や、物理化学的知見の統合など、様々なアプローチが検討されています。また、AlphaFold 3はタンパク質の静的な構造を予測するモデルですが、今後はタンパク質のダイナミクスを考慮したモデルの開発も期待されます。
実験研究との協働
また、AlphaFold 3による予測結果を実験的に検証し、フィードバックすることで、モデルの改良につなげることが重要です。AIと実験研究の協働によって、タンパク質構造予測の発展と応用が加速すると期待されます。DeepMindとIsomorphic Labsは、世界中の研究者とのコラボレーションを通じて、AlphaFold 3の性能向上と応用拡大を目指しています。
倫理的・法的課題への対応
一方で、AlphaFold 3の利用には倫理的・法的な課題もあります。予測結果の解釈や利用には専門知識が必要であり、誤った使用によって悪影響を及ぼす可能性もあります。また、個人情報の保護やデータの帰属など、法的な整備も必要でしょう。技術の発展と並行して、倫理的・法的な議論を深めていくことが求められます。DeepMindとIsomorphic Labsは、AlphaFold 3の利用に関するガイドラインを策定し、責任ある利用を促進していく方針です。
まとめ
AlphaFold 3は、タンパク質構造予測の分野に大きなブレイクスルーをもたらしました。高精度な予測が可能になったことで、創薬や疾患研究、タンパク質デザインなど、幅広い分野での応用が期待されています。
今後もAlphaFold 3の性能向上と応用研究が進むことで、ライフサイエンス分野に革新が起こるでしょう。同時に、倫理的・法的課題にも適切に対応していくことが重要です。
AIによるタンパク質構造予測は、基礎科学から医療応用まで、私たちの生活に大きなインパクトを与える可能性を秘めています。AlphaFold 3の登場は、タンパク質構造予測の新時代の幕開けと言えるでしょう。







コメント